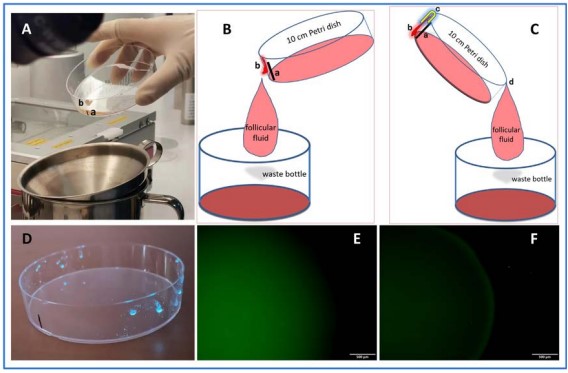
本篇作者提到細菌汙染在實驗室是不允許發生的,因為細菌汙染會導致正在培養的卵子或是胚胎死亡,也會造成可植入的胚胎數減少。而先前的研究顯示主要的汙染來源是精液、其次是取卵過程、還有很少數的汙染是來自實驗室。大部分實驗室進行精液處理時使用密度梯度離心的方式分離精蟲,保留具有活動力的精子,其餘的細胞、細菌、病毒等會被留在上清液,最終被丟棄,大致上在精子的部分可以使用這樣的方法來避免微生物汙染;但在作者的實驗室其實還有一小部份,即使實驗室已經使用了嚴格的條件來做精子洗滌,但仍然有經常性出現感染的情況,所以作者又接著繼續探討授精的步驟。在進行傳統授精的時候,需要在卵子旁邊的卵母細胞、細胞外基質、還有玻尿酸等。作者認為有這麼大面積的Cumulus-Oocyte-Complex是增加微生物進入培養系統的風險。而且授精這個步驟需要卵子與精子一起培養,使得在授精這個步驟更容易讓卵子受到汙染,所以正確的流程來處理Cumulus-Oocyte-Complex是避免污染的重要關鍵。因此作者想要審視及修改Cumulus-Oocyte-Complex的操作過程。
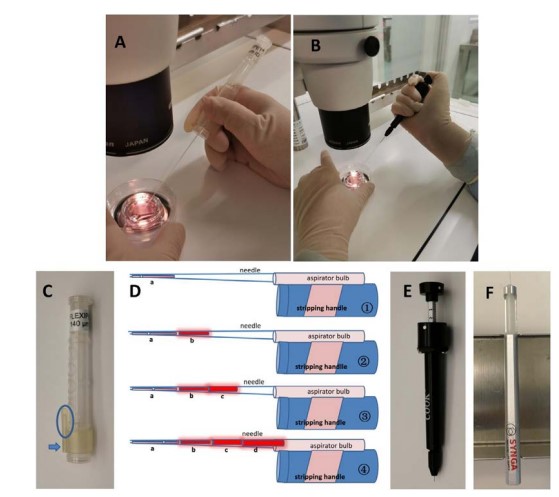
在這個實驗中總共有8734個IVF cycles,其中有6703是傳統IVF cycle,2031是ICSI cycle,發現ICSI cycle的contamination rate是0%, 而IVF cycle的 contamination rate是0.16%。因為有污染的案例,作者就開始研究可能汙染的原因,統計後發現當病人的卵數大於20顆卵,與小於20顆卵相比的話,有較高的汙染機率,所以作者就推測是在取卵的時候可能導致微生物進入培養系統。因此作者就回去檢視了取卵的步驟,發現把從手術房送過來的濾泡液倒入petri dish後,並且找完卵要將dish中的濾泡液倒到廢液桶時,dish旁會殘留衣小滴濾泡液,在這邊作者先將有殘留濾泡液的地方作記號。如果這個dish再倒入第二管濾泡液,一樣找完卵後要將濾泡液倒入廢液桶時,如果這時候是從另外一邊倒的話,原先殘留的一小滴濾泡液就又會流回去,那這樣的作法很有可能會導致環境中的汙染物進入到胚胎培養中。圖1-D可以看到的螢光是我們手上的細菌。再來圖1-E是倒廢液的時候從隨機位置倒掉,並在dish內進行螢光染色,發現裡面有許多微生物被染上螢光;而圖1-F,是每次都從標記位置將濾泡液倒掉,發現dish內並沒有被染上螢光。因為這樣的因素,作者的實驗室後來就都會在倒廢液的地方作上標記。在第一次改善後污染的比率從原先的0.37%降低至0.18%,但還是有兩個污染的case,也一樣是取卵數大於20顆的個案。作者發現在這兩個case中,是在胚胎培養第3天才發現污染的,第1天授精時並沒有發生汙染,所以作者就將剃蛋的步驟進行分析。可以看到圖2-A&C是作者實驗室使用的holding pipette。從2-B圖的圖解可以看到剃蛋的時候pipette有殘留的medium,並沒有辦法完整的排乾淨,接著要剃下一顆蛋的時候,原先殘留的液體就會往上,再剃下一顆,液體就越往上,最後液體就會碰觸到非無菌的地方。所以如要避免這類的汙染,就必須一直將pipette維持在正壓的壓力下,避免排不除的medium往回抽吸。或是更換成新式的holding pipette。最終經過了兩次技術上的改善,從2019年至2021年在3178個案例中都沒有汙染的個案。