染色體異常是隨著女性年齡增加導致生殖能力下降的主要原因之一,同時也是著床失敗與流產的關鍵因素。這些異常可影響整條染色體或其片段,可能涉及缺失、重複、倒位或重排,並可能影響胚胎所有或部分細胞。本文聚焦於可由植入前染色體篩檢(PGT-A)偵測的染色體異常,包括:
1. 全染色體非整倍體(Whole-Chromosome Aneuploidy, WCA)
2. 片段性非整倍體(Segmental Aneuploidy, SA)
3. 全染色體嵌合異常(Whole-Chromosome Mosaicism, WCM)
4. 片段性嵌合異常(Segmental Mosaicism, SM)
其中,WCA 與 SA 通常影響整個胚胎的所有細胞;WCM 與 SM 則多數侷限於部分細胞。PGT-A 圖譜中,WCA 顯示為整數位移,WCM 為分數偏移,SA 與 SM 出現在染色體區段,圖譜讀取則容易受雜訊或偽影干擾,導致判讀不確定。
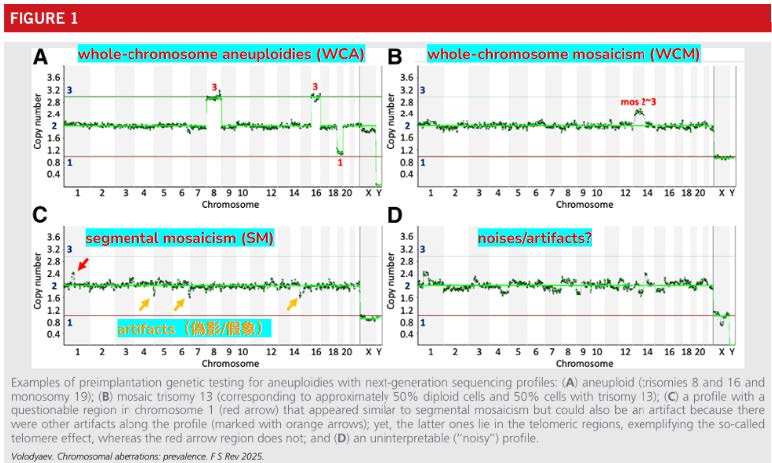
一、全染色體非整倍體(Whole-Chromosome Aneuploidy, WCA)
發生率與年齡關聯
植入前基因檢測(PGT)發現 WCA 的發生率與女性年齡高度相關:
● 在 25–35 歲女性中,WCA 發生率約為 20–30%;
● 在 42–44 歲女性則高達 80–90%。
● 35 歲之後,每增加一歲,WCA 發生率平均上升約 6%。
此趨勢與使用自體卵子的試管嬰兒(IVF)療程中活產率與懷孕率的下降高度吻合,顯示 WCA 是年齡相關不孕的主要染色體機制。
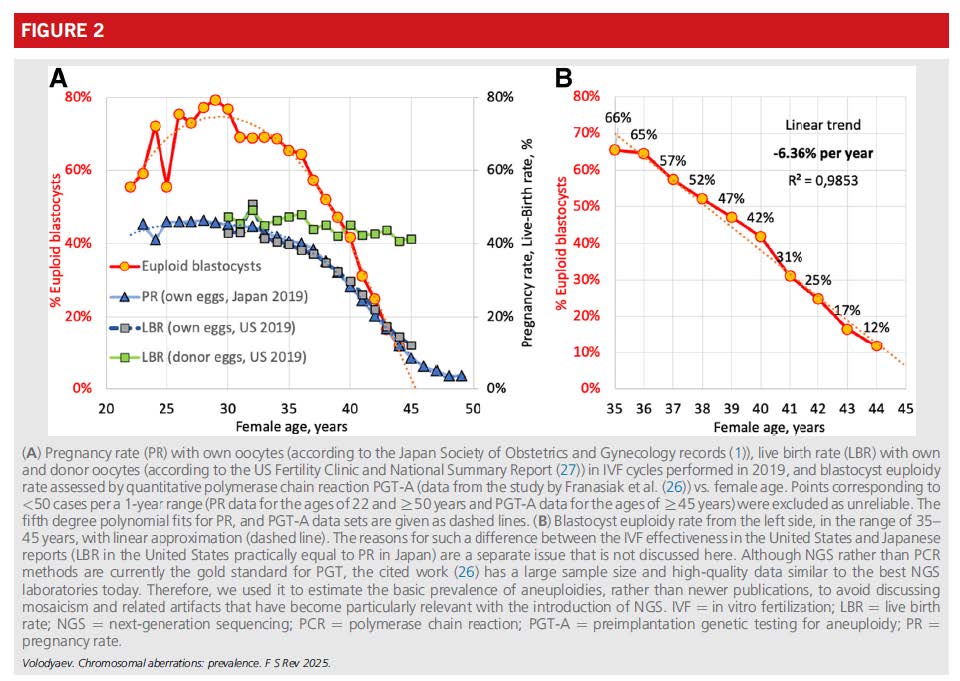
ASRM 臨床建議
根據美國生殖醫學會(American Society for Reproductive Medicine, ASRM)的建議:
● 對於使用自體卵的高齡女性,建議考慮進行 PGT-A。
● 對於接受年輕捐卵者的個案,則無需常規進行 PGT-A。
● 年輕女性與任一年齡的男性亦不建議常規使用 PGT-A。
親本來源
WCA 絕大多數(超過 80–90%)來自母方減數分裂錯誤,父源性僅占 2–3%。大約 5–15% 可能源自受精後第一次有絲分裂出錯。
二、片段性非整倍體(Segmental Aneuploidy, SA)
發生率變異與技術影響
SA 的報告發生率在不同研究間差異甚大,從 3% 到超過 30%。此一變異可能源於實驗室間的差異,包括樣本運送與處理方式、DNA 降解程度、生物資訊分析方法及演算法設定等。即便在同一實驗室內,對診斷為 SA 的胚胎進行多點採樣(multifocal biopsy)後,其一致率僅為 40–50%。
與年齡與 WCA 無關
幾乎所有研究一致指出,SA 的發生率與女性年齡無關,也與全染色體異常(WCA)之間沒有明確的關聯性。SA 的發生機率與染色體長度呈正相關,特別是 q 臂長的染色體區域較容易出現 SA;此外,許多 SA 熱點集中在染色體的末端區域(distal ends)。
父母來源
SA 的來源以父方為主,約有 67–70% 為父源性,僅 30–33% 為母源性。此一分布與 WCA 幾乎相反,WCA 的來源以母源性為主(約 88%)。
發育動態
研究指出 SA 呈現「兩階段變化」的模式 (表一):
● 卵母細胞期:約 3–10%
● 卵裂期:上升至 15–25%
● 囊胚期:下降至 7–15%
此變化可能來自兩種主要機制:一方面,受精後的精子來源與新生的有絲分裂錯誤會導致 SA 增加;另一方面,SA 胚胎可能因發育潛能較差而遭自然淘汰,或異常細胞於發育過程中被選擇性排除。
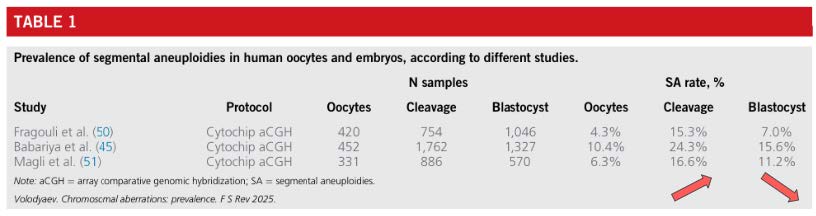
與囊胚品質(Blastocyst Quality)關聯
SA 的存在與囊胚形態品質不良呈顯著相關,尤其在形態分級較低的囊胚中發生率更高。此關聯可能反映以下生物學機制:
● 攜帶 SA 的細胞較容易停滯發育或凋亡,導致囊胚整體結構受損;
● 胚胎可能啟動自我修正機制,將異常細胞排除至滋養外胚層區域,保留正常細胞於內細胞團,影響形態評分。
整體而言,SA 雖與年齡無關,但其存在與胚胎品質下降與停滯風險顯著相關,可能影響胚胎的最終發育潛力。
發生來源與一致性分析
研究將 SA 來源區分為三類:
● 減數分裂來源(meiotic SA):在所有胚胎切片中皆呈非嵌合型(non-mosaic),推定來自減數分裂,比例穩定約佔所有胚胎的 5–10%,與年齡或 WCA 無關,資料可信度高。
● 體細胞分裂來源(mitotic SA):以嵌合型形式出現,僅分布於部分切片,推定源於早期有絲分裂錯誤,發生率差異極大(<0.2% 至 9–12% 不等),易受技術誤差與偽影影響。
● 可疑 SA(questionable SA):僅出現於單一切片,或圖譜表現不清楚,可信度最低。

三、全染色體嵌合異常(Whole-Chromosome Mosaicism, WCM)
發生率與變異性
WCM 的報告發生率在文獻間差異甚大,從低於 3% 到 30–35% 不等。這些差異大多來自技術性偽影、生物資訊分析方法誤差,以及不同實驗室對圖譜的解讀方式差異。 即便使用相同的 NGS 平台(如 Illumina、FAST-SeqS),WCM 的結果仍高度不一致,顯示僅靠平台標準化仍無法排除誤差來源。
多點切片結果與真實性
類似於 SA,WCM 在多點胚胎切片的分析中一致率偏低(僅 27–43%),顯示部分 WCM 實為表觀嵌合體(apparent mosaicism),而非真實的生物現象。
年齡關聯與生物來源
WCM 的發生率隨年齡呈現穩定或微幅上升趨勢(圖三),可能與高齡女性卵子來源的染色體分裂精確度下降有關。 WCM 多源於早期有絲分裂錯誤,可能同時影響父母雙方染色體。其與 WCA 的關聯性不強,僅有輕微重疊(小於 15%)。
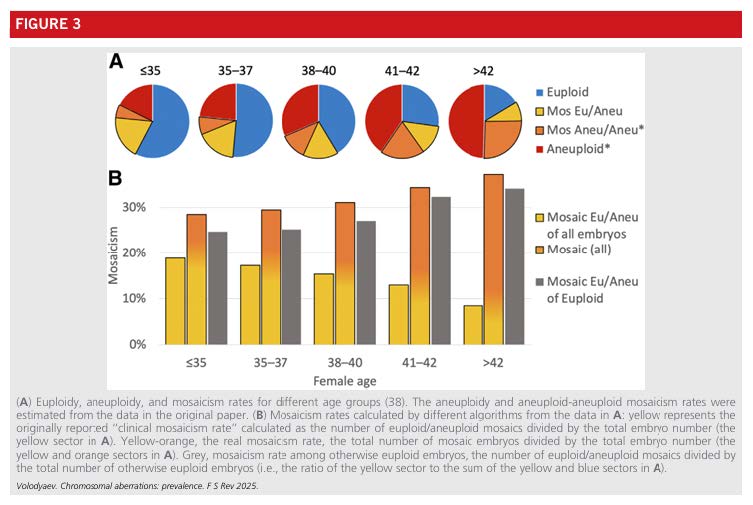
起源與估算挑戰
馬賽克異常(mosaicism)主要起源於早期胚胎發育過程中的有絲分裂錯誤,可能發生在受精卵初次分裂為二細胞的階段,此階段本身即具高度錯誤風險。與減數分裂錯誤不同,有絲分裂錯誤通常會同時影響來自父母雙方的染色體。
目前研究指出,馬賽克異常與母親年齡與胚胎倍體狀態(整倍體與非整倍體)關係不大,其發生率在不同胚胎倍體狀態下差異有限。
根據多項研究使用 FISH 方法估算的嵌合體比例如下:
● 第3天胚胎:44%
● 第4天胚胎:55%
● 囊胚期:61%
● 第3天停滯胚胎:64%
● 第4天停滯胚胎:68%
雖有理論推測嵌合體在囊胚期之後下降,但目前缺乏高品質研究能直接比較不同發育階段之間的變化趨勢,加上檢測誤差大,該假設尚待驗證。
綜合而言,嵌合體的實際盛行率受到高度技術性誤差影響,不同實驗室間估算結果差異極大,且不同基因檢測平台各自具有特定偽陽性或偽陰性風險。若排除這些技術限制,真實的生物性嵌合體可能僅影響不到 15% 的胚胎,甚至可能僅約 5%。
四、片段性嵌合異常(Segmental Mosaicism, SM)
SM 是指染色體部分區段呈現非整倍體狀態,且僅存在於部分細胞中。其圖譜特徵與 SA 類似,但呈現較小幅度偏移。
SM 的發生率報告亦高度不一致,變異原因與 SA、WCM 相似,包括:
● 樣本處理造成的 DNA 降解或擴增不均
● 單一切片樣本難以代表整體胚胎
● 分析平台與演算法設定的差異
目前缺乏高品質的比較研究能準確估算 SM 的真實盛行率。
五、技術誤差與自我修正機制
PGT-A 所報告的嵌合或非整倍體胚胎,其臨床結果變異極大。部分原因可歸因於以下兩類因素:
技術性假象(Artifacts)
● 來自 DNA 降解、擴增不均、FISH 訊號判讀錯誤等
● 特別是在使用單一細胞樣本分析時更易出現
● 使用多細胞切片、保持冷鏈、選擇穩定平台與演算法可降低誤差
自我修正機制(Self-Correction)
● 非整倍體細胞可能停止發育或遭排除
● 正常細胞於發育中占優勢,異常細胞多集中於滋養層,內細胞團較為保留
● 多項研究觀察到即使嵌合胚胎著床,胎兒多為正常核型(高達 98.8%)
六、臨床結果與建議
多項研究顯示,嵌合體或非整倍體胚胎的臨床結果雖不如 euploid 胚胎,但仍可能發育為正常胎兒。以下為主要觀察結果與建議:
● 非整倍體或嵌合體胚胎的著床率與活產率皆低於 euploid 胚胎。
● 一旦成功著床,胎兒多為正常核型(研究指出約 98.8% 無明顯染色體異常)。
● 嵌合程度(高或低)比染色體異常的種類(例如單體或三體)更能預測胚胎的發育潛能。
● 混亂型(chaotic)或高度嵌合的胚胎,其妊娠率明顯下降,流產率亦顯著增加。
臨床建議
● 解讀 PGT-A 結果時應謹慎,結合臨床背景、胚胎形態評估與多點切片結果進行整合判斷。
● 對於高齡且使用自體卵的女性,建議使用 PGT-A 以降低非整倍體植入風險。
● 對於年輕女性與使用捐卵者者,不建議常規使用 PGT-A,因為染色體異常發生率相對低,且可能產生過度篩選。
● 重點應放在提升平台分析的準確性、標準化資料解讀流程,並持續釐清技術性偽影與真實生物異常的界線,以改善臨床預測與輔助生殖決策。
(原始文獻出處:The chromosomal challenge of human embryos: prevalence of aneuploidy and mosaicism. F S Rev_2025;6:100082)



